- 認知症とは
- アルツハイマー病の薬
- 早期発見の重要性
- 超早期発見の重要性と主観的記憶障害
- 高齢者の薬
- 高齢者の生活習慣病
- 生活習慣病と認知症
- 水痘ワクチン(シングリックス・生ワクチン)と認知症の発症抑制
認知症について
認知症とは
認知症とは、何らかの疾患によって、これまでできていたことができなくなり、日常生活や社会生活に支障をきたすようになった状態を指します。
主な症状として、以下のようなものが認められます。
- 記憶障害:少し前のことが思い出せない、覚えていたことを忘れる
- 見当識障害:時間や日付の感覚がわからなくなる、どこにいるのかわからなくなる
- 実行機能障害:計画を立てることが難しくなる、家電やATMなどが使えなくなる
- 理解力・判断力の低下:考えるスピードが遅くなる、普段と違う状況に混乱する
認知症の症状の詳細については後述します。
認知症の原因となる疾患
認知症の原因としては、以下のようなものが挙げられます。
- アルツハイマー病(最も多く、約半数を占めます)
- 血管性認知症(2番目に多い)
- レビー小体型認知症(3番目に多い)
- 前頭側頭型認知症
- 正常圧水頭症
- 混合性認知症
- その他の神経変性疾患(進行性核上性麻痺など)による認知症
- 代謝性疾患に伴う認知症
- 慢性硬膜下血腫
これら以外にも、認知症の原因となる疾患は非常に多く存在し、100種類近くにのぼると考えられています。
専門外来では、認知症の原因を正確に見極めること、そして治療可能な認知症(treatable dementia)を見逃さないことが非常に重要となります。
治療可能な認知症(treatable dementia)
アルツハイマー病、レビー小体型認知症、前頭側頭型認知症などの神経変性疾患による認知症や、血管性認知症については、残念ながら現代医学において認知機能を改善させることはできません。
アルツハイマー病に対しては、抗アミロイド抗体薬による治療が開始されていますが、これも認知機能の低下速度を緩やかにする効果が期待されるものであり、認知機能の改善に至るものではありません。
一方で、認知症の中には治療可能なものが約5〜15%程度含まれているとされています。
以下に、代表的なものを示します。
- 正常圧水頭症
- 慢性硬膜下血腫
- 脳腫瘍
- 甲状腺機能低下症
- ビタミンB12欠乏症
- 葉酸欠乏症
- 側頭葉てんかん
- 多発性硬化症
- 反復する低血糖
- 薬剤性
- その他
これらを見逃さず、適切な治療につなげていくことも、認知症外来の重要な役割です。
そのために、問診や神経診察(全身の動きや反射の評価など)に加え、血液検査や頭部MRIなどの検査を行う必要があります。
また、アルツハイマー病などの根治が困難な認知症が主体である場合でも、治療可能な認知症が合併していることがあります。そのため、認知症の進行を少しでも遅らせる目的で、治療可能な要因については積極的に治療を行っていきます。
薬による認知機能の低下
意外と見落とされやすい原因の一つに、薬剤性の認知機能低下があります。
特に問題となるのは、抗コリン作用を有する薬剤です。
アルツハイマー病の主な治療薬である、ドネペジル(アリセプト、アリドネなど)、ガランタミン(レミニールなど)、リバスチグミン(イクセロン、リバスタッチなど)は、いずれもコリンエステラーゼ阻害薬に分類されます。これらの薬剤は、脳内のアセチルコリンを増加させることで、認知機能の維持を図るものです。
一方、抗コリン薬はこれとは逆の作用を有するため、認知機能を低下させる危険性があります。
- 睡眠薬や抗不安薬(特に長時間作用型のベンゾジアゼピン系)
- 三環系抗うつ薬
- 一部のパーキンソン病薬(トリヘキシフェニジル・ビペリデン)
- 第1世代の抗ヒスタミン薬(眠気の出やすいアレルギーの薬)
- H2受容体拮抗薬(一部の胃薬)
- 過活動膀胱薬(特にオキシブチニン)
特に、睡眠薬、胃薬、抗ヒスタミン薬は使用頻度が高いため、注意が必要です。
また、上記のリストに含まれない抗コリン作用が比較的弱い薬剤であっても、複数を併用することにより、認知機能に悪影響を及ぼす危険性があります。
このような薬剤の確認のため、受診時には必ずお薬手帳をご持参ください。
認知症の主な症状(中核症状)
認知症の主な症状(中核症状)には、以下のものがあります。
- 記憶障害
- 見当識障害
- 実行機能障害
- 理解力・判断力の低下
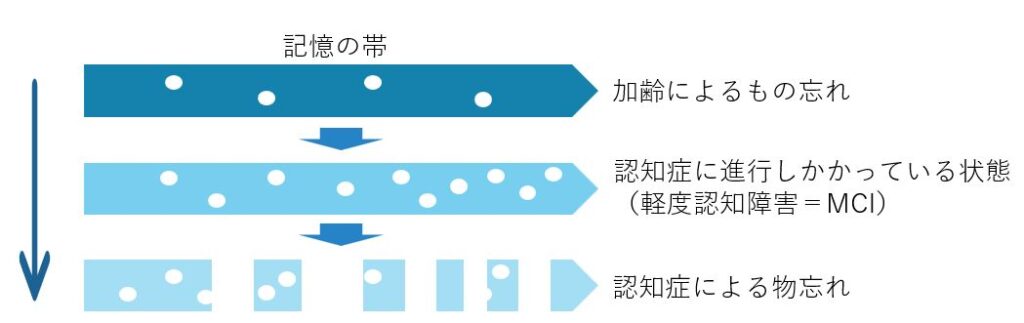
記憶障害とは、少し前のことが思い出せない、覚えていたことを忘れる、といった症状です。アルツハイマー病の初期から認められます。
一方で、健常な場合であっても、物忘れがまったく起こらないわけではありません。
以下に、加齢による物忘れ(生理的な物忘れ)と、認知症による物忘れ(病的な物忘れ)の違いを示します。
なお、両者の間には中間的な段階の物忘れも存在しており、明確に区別することが難しい場合もあります。
見当識障害とは、時間や日付の感覚がわからなくなる、どこにいるのかわからなくなる、といった症状です。アルツハイマー病では、発症早期から日付がわかりにくくなるといった症状が認められます。
実行機能障害とは、計画を立てることが難しくなる、家電やATMなどが使えなくなる、といった症状です。
理解力・判断力の低下とは、普段と違う状況に混乱する、複雑なことを処理できなくなる、といった症状です。
認知症の周辺症状・BPSD
中核症状以外にも、周辺症状と呼ばれる問題行動が認められることがあります。
これらは BPSD(行動・心理症状) と総称され、日常生活能力の低下や、介護負担の増大につながります。
BPSDには、以下のような症状があります。
- 易怒性、暴言、暴力
- 抑うつ、食欲や意欲の低下
- 被害妄想、物盗られ妄想、嫉妬妄想など
- 徘徊
- 介護拒否
- 不安、興奮
- 幻覚
- 常同行動(同じ行動を繰り返す)、性的逸脱行動
これらの症状は、病気の進行そのものによって生じる場合もあれば、生活や介護の環境、投薬の影響によって引き起こされる場合もあります。
BPSDの対処法
BPSDに対処するにあたっては、まず以下の点を確認することが重要です。
- 体調不良がないか(痛み、便秘、頻尿など)
- 不適切な薬剤が使用されていないか(副作用により混乱をきたすことがあります)
- 生活環境が適切か(室温や照明、独居など)
- 不適切な介護や対応が行われていないか
これらの確認に加え、必要に応じて
- 介護サービスの見直し
- 薬物療法
を検討することがあります。
BPSDで困ったことがある場合には、専門医、ケアマネジャー、地域包括支援センターなどに相談することが大切です。
専門医では、体調不良や不適切な薬剤使用の有無について評価が可能です。
介護上の問題については、ケアマネジャーがケアプランの作成や見直しを行います。
ケアマネジャーがいない場合には、地域包括支援センターに相談するとよいでしょう。
また、BPSDが認められた際に、介護者が「注意する」「間違いを指摘する」「怒る・けなす」といった対応を行っていないかを振り返ることも重要です。
認知症では、「物忘れをしている」「うまくできていない」という自覚が乏しく、さらにそれを自分で修正することができません。そのため、何度注意されても行動が改善することはなく、「注意」や「間違いの指摘」は効果を示しません。
認知症介護においては、本人の現在の能力以上のことを求めないことが非常に大切です。
しかし、その一方で介護者の負担が増大すると、「怒る・けなす」といった言動につながりやすくなります。
そのため、介護保険サービスを上手に利用し、適度な距離を保つことで、介護負担の軽減を図ることが必要です。
BPSDへの対応では、環境調整や介護方法の工夫に加え、薬物療法が有効となる場合もあります。
薬物療法としては、統合失調症、うつ病、てんかんなどに使用される薬剤を転用することが多いのが現状ですが、アルツハイマー病に伴う興奮症状については、2024年にブレクスピプラゾールが適応を取得しています。
当院では、ブレクスピプラゾールを含め、副作用に十分注意しながら慎重に薬物療法を行っています。
BPSDに対する薬物治療では、症状を完全に消失させることを目標とするのではなく、介護上許容できる程度までの改善を目指すことが重要と考えられます。
その理由として、症状の完全な消失は困難であること、また、それを目指すことで薬剤の高用量投与が必要となり、副作用のリスクが高まることが挙げられます。
認知症の検査
認知症の検査について、血液検査・心理検査・頭部画像検査を行います。
血液検査
認知機能の低下に直接関係する、甲状腺機能低下症・ビタミンB欠乏症などの異常がないか確認します。
また、血管性認知症のリスクにもなる糖尿病や脂質異常症の評価も行います。
その他、栄養状態・肝機能・腎機能、また、状態に応じて心機能などの評価を行います。
心理検査
初回検査として、MMSE (Mini-Mental State Examination) を実施します。
MMSE で異常が認められない場合であっても認知機能の低下が疑わしい場合は、1段階難しい MoCA-J (Montreal Cognitive Assessment-Japanese) を実施することがあります。
また、症状に応じて前頭葉機能検査である FAB (Frontal assessment battery) や、自動車運転に関する評価が必要な場合には、TMT (Trail Making Test) を実施します。
MMSEの解釈
MMSE は30点満点の検査で、時間・場所の見当識、即時再生、計算、短期記憶、物品呼称、復唱、三段階命令、読字、書字、図形模写の項目からなります。
各項目ごとに点数が割り振られており、総合点を算出しますが、これをもって認知機能を評価するのはあまり適切ではありません。
もちろん、極端に低い点数であれば様々な能力の低下が示唆されますが、高得点の場合は失点した設問を注意深く確認する必要があります。
例えば、計算で3点失点した27点と、短期記憶で3点失点した27点では、後者のほうが日常生活に対する影響が大きく、また、よりアルツハイマー病らしさを認めます。こういった場合、27点だから安心するのではなく、より積極的な検査や治療(抗アミロイド抗体の投与を含む)を検討する必要があります。
また、MMSEは長谷川式と点数の互換性がないことも留意しておく必要があります(一般的にMMSEの方が点数が高い傾向があります)。
頭部MRI・CT検査
アミロイドPET検査
DaT Scan
アルツハイマー病の薬物療法
現在用いられているいずれの薬剤も、アルツハイマー病そのものを改善させる効果はなく、病状の進行を抑制することを目的とした治療となります。
コリンエステラーゼ阻害剤
2007年に、初めてのアルツハイマー病治療薬としてドネペジル(アリセプト)が発売されました。その後、同系統の薬剤であるガランタミン(レミニール)やリバスチグミン(リバスタッチ、イクセロン)が相次いで使用可能となりました。
これらはいずれもコリンエステラーゼ阻害薬に分類され、脳内のアセチルコリンを増加させることで、認知機能の維持を図る薬剤です。
これらの薬剤は、意欲低下が認められる場合には改善傾向を示すことがありますが、一方で興奮を引き起こし、BPSDが悪化する可能性もあります。そのため、投与の適否については慎重な判断が必要となります。
各薬剤の特徴は以下のとおりです。
- リバスチグミン:貼付剤のみで、軽度から中等度のアルツハイマー病に使用可能です。
- ドネペジル:錠剤、ゼリー剤、貼付剤の剤型があります。
- ガランタミン:錠剤のみで、軽度から中等度のアルツハイマー病に使用可能です。
副作用として、吐き気などの消化器症状が認められることがありますが、内服薬と比べて貼付剤では消化器症状が少ない傾向があります。
NMDA受容体拮抗薬
2011年に、メマンチン(メマリー)が発売されました。
メマンチンは、NMDA受容体拮抗薬に分類される薬剤で、前述のコリンエステラーゼ阻害薬と併用することが可能です。
メマンチン自体は鎮静薬ではありませんが、興奮を抑え、落ち着きが得られる傾向があり、BPSDに対して一定の効果が期待されます。
剤型は錠剤のみで、中等度から重度のアルツハイマー病に使用可能です。
抗アミロイドβ抗体
2023年に抗アミロイド抗体薬であるレカネマブ(レケンビ)が発売され、翌2024年にはドナネマブ(ケサンラ)が発売されました。
これらは抗アミロイドβ抗体薬に分類され、アルツハイマー病の原因物質の一つであるアミロイドβに結合し、脳内から除去する作用を有します。従来の治療薬と比べ、より病気の本質に迫った治療薬であるといえます。
一方で、投与の対象は、アルツハイマー病による軽度認知障害(MCI)から軽度アルツハイマー病に限定されています。また、効果や副作用(ARIAと呼ばれる脳浮腫など)の観点から、できるだけ早期に投与を開始することが望ましいと考えられています。
薬剤自体が非常に高額であることに加え、投与可否の判定にはアミロイドPET検査や髄液検査といった追加検査が必要となり、いずれも容易ではありません。そのため、治療開始までのハードルは比較的高いといえます。
さらに、投与開始後は費用面の負担に加え、頻回の通院が必要となります。
治療スケジュールは以下のとおりです。
- レカネマブ:2週に1回の点滴治療を1年6か月間継続
- ドナネマブ:4週に1回の点滴治療を1年〜1年6か月間継続
いずれの薬剤においても、治療経過中に脳浮腫(むくみ)や脳出血が生じていないかを評価するため、定期的に頭部MRI検査を行う必要があります。
効果としては、1年6か月の投与期間において約25%の進行抑制が認められたとされています。しかし、金銭的負担(高額療養費制度の利用は可能)や頻繁な通院による負担が問題となるため、治療導入については十分な検討が必要です。
現時点では、抗アミロイド抗体薬を含め、アルツハイマー病を改善させたり、進行を完全に止めたりする治療法は存在しません。
しかし、これらの薬剤の使用に加え、身体的問題の是正、生活習慣の改善、社会的要因への介入などを行うことで、アルツハイマー病を含む認知症の進行を抑制できる可能性は十分にあります(認知症の発症抑制については後述します)。
早期発見・早期治療の重要性
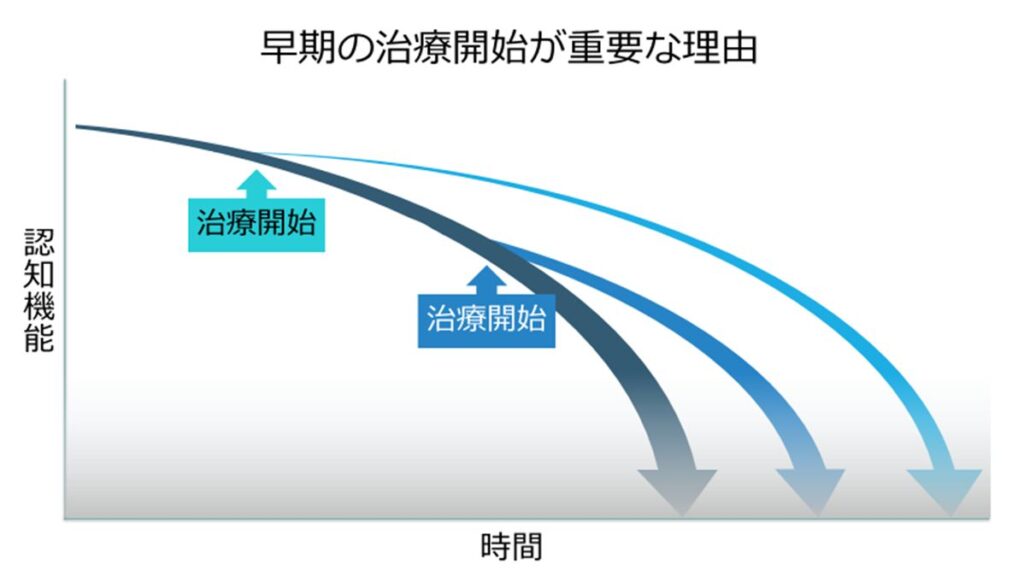
アルツハイマー病は、現時点では認知機能の改善を期待することはできず、進行を遅らせることが治療の主な目的となります。
そのため、下記の図に示すように、できるだけ早期から治療を開始し、認知機能が保たれている期間をできる限り長く維持していくことが重要です。
超早期発見と主観的記憶障害
前述のとおり、アルツハイマー病は、現時点では認知機能の改善を期待することはできず、進行を遅らせることが治療の主な目的となります。そのため、できるだけ早期から治療を開始し、認知機能が保たれている状態を長く維持していくことが重要です。
近年、抗アミロイド抗体薬による治療が登場したことにより、アルツハイマー病の発症前からの発見(超早期発見)の重要性が高まっています。
では、まだ発症していないアルツハイマー病を捉える手がかりは何でしょうか。
その一つとして注目されているのが、主観的認知機能低下(SCD:Subjective Cognitive Decline)です。
SCDとは、周囲からは明らかな認知機能低下を指摘されないにもかかわらず、本人が持続的に認知機能の低下を自覚している状態を指します。
これは、軽度認知障害(MCI)よりも前の段階に位置づけられると考えられています。
SCD → MCI → 認知症
SCDの段階では、アルツハイマー病のバイオマーカー(アルツハイマー病に関連して変化する検査所見)が陽性となる割合が、SCDを認めない場合と比べて高いことが知られています。また、将来的にMCIやアルツハイマー病へ移行するリスクも高いことが、近年の研究で明らかになってきています。
周囲から物忘れを指摘されていなくても、ご自身で物忘れが気になる場合には、一度ご相談ください。
精密検査をすぐに行わない場合であっても、経過を追っていくことで、進行が認められた際に早期治療につなげることが可能となります。
高齢者の薬について
副作用が出やすい傾向
一般的に、投与された薬は腎臓から排泄されるか肝臓で代謝され、体外に排出されていきます。
高齢者において、腎・肝ともに機能の低下を来しているため、通常の量を投与しても実質的に過量投与となる危険性があります。
また、特定の薬が効きにくい または 効きやすい といったこともあり、個別に投与量の調節を行う必要があります。
さらに、複数の疾患に対して数多くの薬が投与されていることが多いため、各々の相互作用や重複する副作用にも注意を払う必要があります。
こういった点から、通常の成人と比べ、高齢者への投薬は慎重さが必要となります。
通常、錠剤は1錠単位で処方するのですが、それでは効き過ぎてしまうことがあるため、0.5錠や0.25錠で処方することも少なくありません。こういった場合は、薬局に依頼し錠剤を割ってもらう必要があり、通常より一手間かかりますが、こういった治療が必要なのが高齢者なのです。
薬について、昔と比べると1日1回の内服でよいものが増えました。これらの薬は内服の手間が省ける点で大変良いのですが、体内から出ていくまでにかかる時間(半減期)が長い傾向があります。
半減期が長い薬は、飲み始めてから効果が安定するまでに、おおよそ半減期の5倍程度の時間がかかるとされています。
例えば、高血圧でよく使われるアムロジピンの半減期は30時間以上となっています。安定して効果が得られるようになるまでに1週間かかる計算になります。
逆に、血圧が下がりすぎてしまって薬をやめたとしても、効果がなくなるまで少なくとも数日(計算上は1週間程度)はかかる計算になります。
こういった薬の性質も考慮しながら、調整を行っています。
高齢者の生活習慣病
生活習慣病とは、食習慣、運動習慣、休養、喫煙、飲酒などの生活習慣が、発症や進行に深く関与する疾患の総称です。
具体的には、がん、循環器疾患(心臓や血管の病気)、糖尿病、慢性閉塞性肺疾患(COPD)などが挙げられます。これらの疾患は、喫煙、高血圧、脂質異常症(高コレステロール血症)、糖尿病、過度の飲酒などが主な原因となって発症・進行します。
なぜ、生活習慣病を管理しないといけないのか?
生活習慣病は、初期には自覚症状に乏しく、患者さんご本人が特に不自由を感じることは少ない疾患です。しかし、そのまま放置すると、がん、心筋梗塞、脳梗塞、腎不全などを引き起こす危険性が高くなります。
これらの疾患は、生命予後に大きな影響を及ぼすだけでなく、たとえ命に直結しなくても、生活の質(QOL)を著しく低下させる可能性があります。
がんや心筋梗塞は言うまでもなく、脳梗塞によって麻痺などの後遺症が残ったり、腎不全により人工透析が必要となったりする事態を避けるためにも、生活習慣病を適切に管理していくことが重要です。
約100年前、ウィリアム・オスラー博士は
「人は血管とともに老いる」
という言葉を残しています。この言葉は、寿命が延びた現代において、ますます重要な意味を持つようになっています。
すなわち、血管の若さをいかに保つかが、健康寿命を延ばす鍵であると考えられます。そのため、高血圧、糖尿病、脂質異常症(コレステロール異常)の管理は非常に重要であり、できるだけ若い段階から適切にコントロールしていく必要があります。
特に近年では、LDLコレステロールの影響が注目されています。
高齢者の生活習慣病をどのように管理していくのか
規則正しい生活、禁煙、適切な食事、運動習慣、飲酒量の低減、十分な休養といった生活習慣の改善は、生活習慣病の管理において非常に重要です。これらを抜きにして、生活習慣病の本質的な改善は望めません。
一方で、これらをすべて実践し、生活習慣病を完全に克服することは、現実には容易ではないのも事実です。
特に高齢者の場合、自主的な生活習慣の修正は難しく、とくに食事の変更は食思不振からフレイルを招く可能性すらあります。
そのため、高齢者の生活習慣病管理では、薬物療法を積極的に活用する方針をとっています。
体重管理に関しても、低体重より過体重傾向にある方が健康寿命の延長が期待できます。
高齢者の安易なカロリー制限は、筋肉量の低下を招き、フレイルの原因となり得ます。
そういった、高齢者の特徴を理解し、相反する治療を両立させつつ、通常よりも狭い安全域の中で薬の調整を行い、ご本人の能力・ご家族の支援・社会資源の利用からなる様々な制限を考慮し、継続可能な治療方針を立てることが、高齢者内科の難しさでもあり、醍醐味でもあります。
様々な治療ガイドラインが発効される時代となっていますが、一人一人の状況が大きく異なる高齢者の医療において、単純にガイドライン通りの治療はできません。もちろん、エビデンスの詰まったガイドラインは大変参考になります。これを意識しながら、常に最善策を模索し続ける医療を行っています。
高血圧(詳しくはこちら)
2型糖尿病(詳しくはこちら)
脂質(コレステロール)異常症(詳しくはこちら)
生活習慣病と認知症
生活習慣病は認知症の発症リスクとなる
脂質異常症(コレステロール異常)、高血圧、糖尿病といった生活習慣病は、認知症の発症リスクとなることが以前から指摘されてきました。
これらの生活習慣病は動脈硬化を引き起こし、脳梗塞の原因となります。脳梗塞によって認知機能が低下することは、比較的理解しやすいでしょう。
しかし近年では、脳梗塞を原因とする血管性認知症だけでなく、アルツハイマー病の発症にも生活習慣病が関与していることが明らかになってきています。その詳しいメカニズムについてはいくつかの仮説がありますが、ここでは割愛します。
認知症の発症リスクを下げるためには、中年期から生活習慣病を適切に管理することが重要であると考えられています。
ある研究では、中年期からLDLコレステロールが高い場合、将来的な認知症の発症リスクが約7%高くなると報告されています。同様に、高血圧や糖尿病も、それぞれ約2%ずつ認知症の発症リスクを高めると考えられています。
さらに、これら以外にも、生活習慣の改善など本人の心がけによって修正可能なリスク因子は多数存在しており、それらを総合的に管理することで、最大で約45%の認知症発症リスクを低下させられる可能性があるとされています。
この知見は、The Lancet Commission による報告(2024年)に基づくものです(出典:The Lancet Commissions Volume 404, Issue 10452p572-628August 10, 2024)。
認知症のリスクのうち修正(対応・治療)が可能なもの
認知症の発症リスクの中には、生活習慣の改善や治療によって修正(低減)可能な因子が複数存在します。主なものは以下のとおりです。
- 中年期からの高LDLコレステロール血症:7%
- 難聴:7%
- 教育不足:5%
- 社会的孤立:5%
- 頭部外傷:3%
- うつ病:3%
- 大気汚染:3%
- 運動不足:2%
- 喫煙:2%
- 糖尿病:2%
- 視力低下:2%
- 高血圧:2%
- 過度の飲酒:1%
- 肥満:1%
認知症予防においては、とくに中年期からの対策が極めて重要です。
これらの中には、現実的には完全な改善が難しい要因も含まれていますが、すべてを合計すると、最大で約45%の認知症発症リスクを低減できる可能性があるとされています。
なお、近年、先進国では認知症の発症リスク自体は低下傾向にあります。その背景には、教育水準の向上や生活習慣病に対する治療の進歩があると考えられています。
一方で、日本では高齢者人口の増加が著しいため、個人あたりの発症リスクは低下しても、当面は認知症患者の総数が増加することが予測されています。
水痘ワクチン(シングリックス・生ワクチン)と認知症の発症抑制
水痘ウイルスに対するワクチン接種は認知症の発症を抑制する
水痘(水疱瘡)は、小児期に感染することの多い疾患で、以前はその年代の8割程度が罹患する疾患でした。
近年はワクチン接種の影響で、発症率が激減し、1割程度となっています。
水痘に罹患すると、水痘ウイルスが神経に生涯にわたって潜伏し、免疫力が低下した時に帯状疱疹として出現します。
この帯状疱疹を防ぐために、水痘生ワクチン(ゾスタバックス)や、遺伝子組み換えワクチン(シングリックス)の投与が行われ、とくにシングリックスは2回接種することで帯状疱疹の発症を強力に抑制します。
近年、これらのワクチンが認知症の発症を抑制する可能性が高いことがわかってきました。
2025年に科学雑誌「Nature」に掲載された論文「A natural experiment on the effect of herpes zoster vaccination on dementia」では、水痘生ワクチンの投与によって、アルツハイマー病を含む認知症の発症リスクが低下することが示されました(相対リスク低下で20%)。
この効果は女性において顕著でありました。
なお、この研究ではシングリックスが広く用いられていなかったため、調査対象になっていません。
2026年に「Nature Communications」に掲載された「Recombinant zoster vaccine is associated with a reduced risk of dementia」では、シングリックスの投与と認知症発症の関連性について研究されています。
この研究では、シングリックスを2回接種すると、アルツハイマー病や血管性認知症の発症リスクが大きく低下することが示されました(調整ハザード比で0.49)。
この研究でも女性の方が効果が強く認められました。
2024年に「Nature Medicine」に掲載された論文「The recombinant shingles vaccine is associated with lower risk of dementia」では、水痘生ワクチンよりもシングリックスの方が認知症の発症を抑制する能力が高いことが示されました。
この結果も、女性の方が効果が高いという結果でした。
なお、前頭側頭型認知症とレビー小体型認知症に対しては抑制効果が得られませんでした。
発症抑制のメカニズム
現時点では不明となっていますが、いくつかの説が唱えられています。
ワクチンに含まれるアジュバント(免疫賦活剤)による作用や水痘ウイルスによる神経障害の回避によるものである可能性が検討されています。
ワクチン接種の是非
シングリックスは、帯状疱疹の発症を強力に抑えることがでできることがわかっています。
安全性についても高く、帯状疱疹を抑制するという一点においても十分に接種する価値があるといえます。
副次的に認知症の発症を抑制することができる可能性が高いという点も、積極的な接種に値すると考えられます。
費用は安くありませんが、これらの効果を考えると決して高いものではないと思います。
特に、公費で補助が出る場合は積極的な接種を強くおすすめします。
